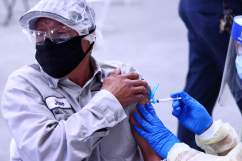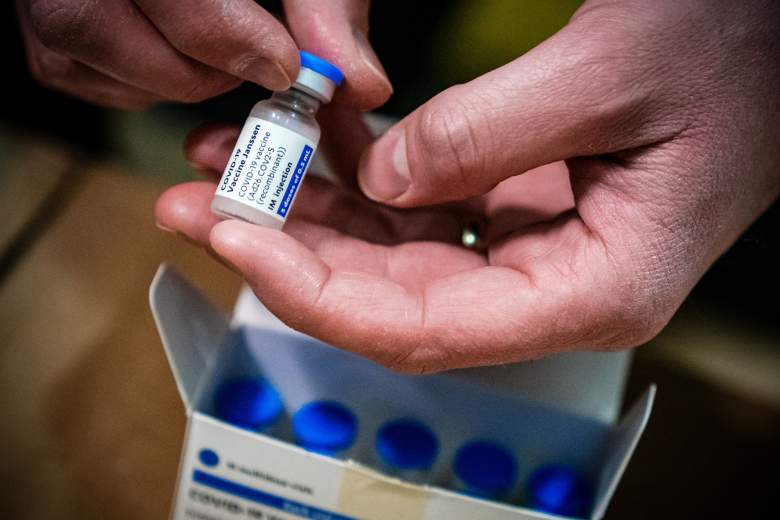
Este martes 13 de abril los CDC (Centros para el Control y Prevención de Enfermedades) y la FDA (Administración de Alimentos y Medicamentos de Estados Unidos) pidieron que se suspenda la distribución y administración de la vacuna contra el COVID-19 de una sola dosis producida por Johnson & Johnson en EStados Unidos.
La alerta fue lanzada por las autoridades de salud del país, luego de que se conociera que 6 personas que se la han aplicado reportaron la aparición de coágulos, hecho que causó preocupación.
Los CDC y la FDA advirteron que hasta ahora se han administrado más de 6,8 millones de dosis de la vacuna Johnson & Johnson en el país y se están revisando los datos de seis casos notificados de “un tipo raro y grave de coágulo de sangre en individuos después de recibir la vacuna.
Y tras conocerse el llamado de los organismos federales, quienes están haciendo una revisión detallada a los informes de los coágulos registrados, la pregunta que muchos pacientes que se han aplicado ya la vacuna de Johnson & Johnson es qué deben hacer ellos y si deberían tener algún tipo de preocupación.
Ante esa inquietud, aunque insistieron que las reacciones adversas reportadas sobre coágulos son muy pocas, tanto los CDC como la FDA hicieron una advertencia que vale la pena tener en cuenta para quienes sientan algún tipo de síntomas específicos que detallaron en un comunicado.
“Las personas que hayan recibido la vacuna J&J y que desarrollen dolor de cabeza intenso, dolor abdominal, dolor en las piernas o dificultad para respirar dentro de las tres semanas posteriores a la vacunación deben comunicarse con su proveedor de atención médica”, manifestaron el Dr. Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA y a la Dra. Anne Schuchat, directora adjunta principal de los CDC en un comunicado conjunto que puedes leer completo aquí.
Al mismo tiempo, los funcionarios hicieron un llamado a los médicos y personal clínico que esté en contacto con la vacuna y personas vacunadas con la dosis de Johnson & Johnson.
“Se solicita a los proveedores de atención médica que notifiquen los eventos adversos al Sistema de notificación de eventos adversos de las vacunas en https://vaers.hhs.gov/reportevent.html”, agregaron.
A pesar de que los CDC y la FDA están tomando con mucha seriedad las denuncias de la aparición de coágulos, insistieron que debe prevalecer la calma.
“En este momento, estos eventos adversos parecen ser extremadamente raros. La seguridad de la vacuna COVID-19 es una prioridad máxima para el gobierno federal, y tomamos muy en serio todos los informes de problemas de salud posteriores a la vacunación COVID-19”, advirtieron los funcionarios.
“En estos casos, se observó un tipo de coágulo de sangre llamado trombosis del seno venoso cerebral (CVST) en combinación con niveles bajos de plaquetas en sangre (trombocitopenia). Los seis casos ocurrieron entre mujeres de entre 18 y 48 años, y los síntomas se presentaron de 6 a 13 días después de la vacunación. El tratamiento de este tipo específico de coágulo sanguíneo es diferente del tratamiento que normalmente se administra. Por lo general, se usa un medicamento anticoagulante llamado heparina para tratar los coágulos de sangre. En este contexto, la administración de heparina puede ser peligrosa y es necesario administrar tratamientos alternativos”, explicaron.
“Los CDC convocarán una reunión del Comité Asesor sobre Prácticas de Inmunización (ACIP) el miércoles para revisar más a fondo estos casos y evaluar su importancia potencial. La FDA revisará ese análisis ya que también investiga estos casos. Hasta que se complete ese proceso, recomendamos una pausa en el uso de esta vacuna por precaución”, advirtieron los voceros de los CDC y FDA. “Esto es importante, en parte, para garantizar que la comunidad de proveedores de atención médica esté consciente del potencial de estos eventos adversos y pueda planificar el reconocimiento y manejo adecuados debido al tratamiento único requerido con este tipo de coágulo sanguíneo”.