Getty Images
Este martes la farmacéutica Moderna, difundió un comunicado en el que informó el inicio de un estudio de su vacuna para contrarrestar el Covid-19 en niños menores de 12 años, que incluirá a los bebés de hasta 6 meses de edad.
El estudio, denominado “KidCove”, lo está realizando la farmacéutica Moderna en colaboración con el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID), parte del Institutos Nacionales de Salud (NIH) y de la Autoridad de Investigación y Desarrollo Biomédico Avanzado (BARDA), parte del Oficina del Asistente Secretario de Preparación y Respuesta de la Departamento de Salud y Servicios Humanos de los Estados Unidos.
Para obtener más información sobre la prueba, incluido el proceso de inscripción de participantes, visite www.kidcovestudy.com.
“Este estudio de fase 2/3 de dos partes, de etiqueta abierta, escalada de dosis, desescalado de edad (Parte 1) y estudio de expansión aleatorizado, ciego al observador y controlado con placebo (Parte 2) evaluará la seguridad, tolerabilidad, reactogenicidad y eficacia de dos dosis de ARNm-1273, administradas con 28 días de diferencia. La Compañía tiene la intención de inscribir a aproximadamente 6.750 participantes pediátricos en los EE.UU. y Canadá, desde los 6 meses hasta menores de 12 años de edad”.
Este anuncio se hizo, justo cuando se cumplió el primer año de que la 1ª dosis de prueba de la vacuna creada en los Institutos Nacionales de Salud de los Estados Unidos fue inoculada en el primer adulto. Esta inyección, ahora es utilizada en el plan de vacunación del país y de otros tantos en el mundo.
“Estamos contentos de iniciar este estudio de la fase 2/3 de mRNA-1273 en niños en Estados Unidos y Canadá”, dijo en el comunicado el CEO de Moderna, Stephane Bancel, en declaraciones citadas por Telemundo 51.
Además, el CEO de Moderna en el comunicado, añadió que “nos alienta el análisis primario del estudio de fase 3 COVE de ARNm-1273 en adultos mayores de 18 años y este estudio pediátrico nos ayudará a evaluar la seguridad potencial e inmunogenicidad de nuestra vacuna candidata COVID-19 en esta importante población de edad más joven”.
¿Qué dosis suministrar?
En la Parte 1, cada participante de 2 años hasta menores de 12 años, puede recibir uno de dos niveles de dosis (50 ug o 100 ug). También en la Parte 1, cada participante desde los seis meses hasta menos de 2 años, puede recibir uno de los tres niveles de dosis (25 ug, 50 ug y 100 ug). Y se llevará a cabo un análisis intermedio para determinar qué dosis se utilizará en la Parte 2, la parte del estudio de expansión controlada con placebo, informó Moderna en su comunicado.
Así, se hará un seguimiento de los participantes durante 12 meses después de la segunda vacunación. La eficacia de la vacuna se deducirá mediante el logro de un correlato de protección, si se establece, o mediante un puente inmunológico para la población de adultos jóvenes (18-25 años). La evaluación de la seguridad y reactogenicidad de la vacuna también es un criterio de valoración principal del estudio. Según Ultimahora.
Vacunas de Moderna para adolescentes
Otro anuncio que el laboratorio Moderna informó es sobre las pruebas que viene realizando en adolescentes de entre 12 y 17 años de edad, pero estableció a mediados de enero que los estudios no iban en buena marcha, debido a que el reclutamiento de voluntarios iba a ritmo lento, y de los 3.000 que se esperaban, solo un grupo de 800 había logrado reunirse. Por tanto hasta el momento no han podido presentar ningún dato de hallazgos.
Asimismo, el presidente ejecutivo de la compañía farmacéutica, Stéphane Bancel, anunció que los resultados de la investigación solo podrían salir a la luz en el mes de septiembre de este año, añadiendo sobre la vacuna de niños pequeños de 6 meses a 12 años, que la vacuna para ellos requeriría una reducción en las dosis, pero que estos estudios no serían hechos hasta 2022, informó CNN.
En el comunicado se lee:
Moderna Inc. una compañía de biotecnología pionera en terapias y vacunas de ARN mensajero (ARNm), anunció que en la Parte 1, cada participante de dos años a 12 años puede recibir uno de dos niveles de dosis (50 μg o 100 μg). También en la Parte 1, cada participante de seis meses a menos de 2 años puede recibir uno de los tres niveles de dosis (25 μg, 50 μg y 100 μg). Se llevará a cabo un análisis intermedio para determinar qué dosis se utilizará en la Parte 2, la parte del estudio de expansión controlada con placebo. Se hará un seguimiento de los participantes durante 12 meses después de la segunda vacunación. La eficacia de la vacuna se deducirá mediante el logro de un correlato de protección, si se establece, o mediante un puente inmunológico para la población de adultos jóvenes (18-25 años). La evaluación de la seguridad y reactogenicidad de la vacuna también es un criterio de valoración principal del estudio. El identificador ClinicalTrials.gov es NCT04796896.
Moderna refuerza su vacuna para el Covid-19
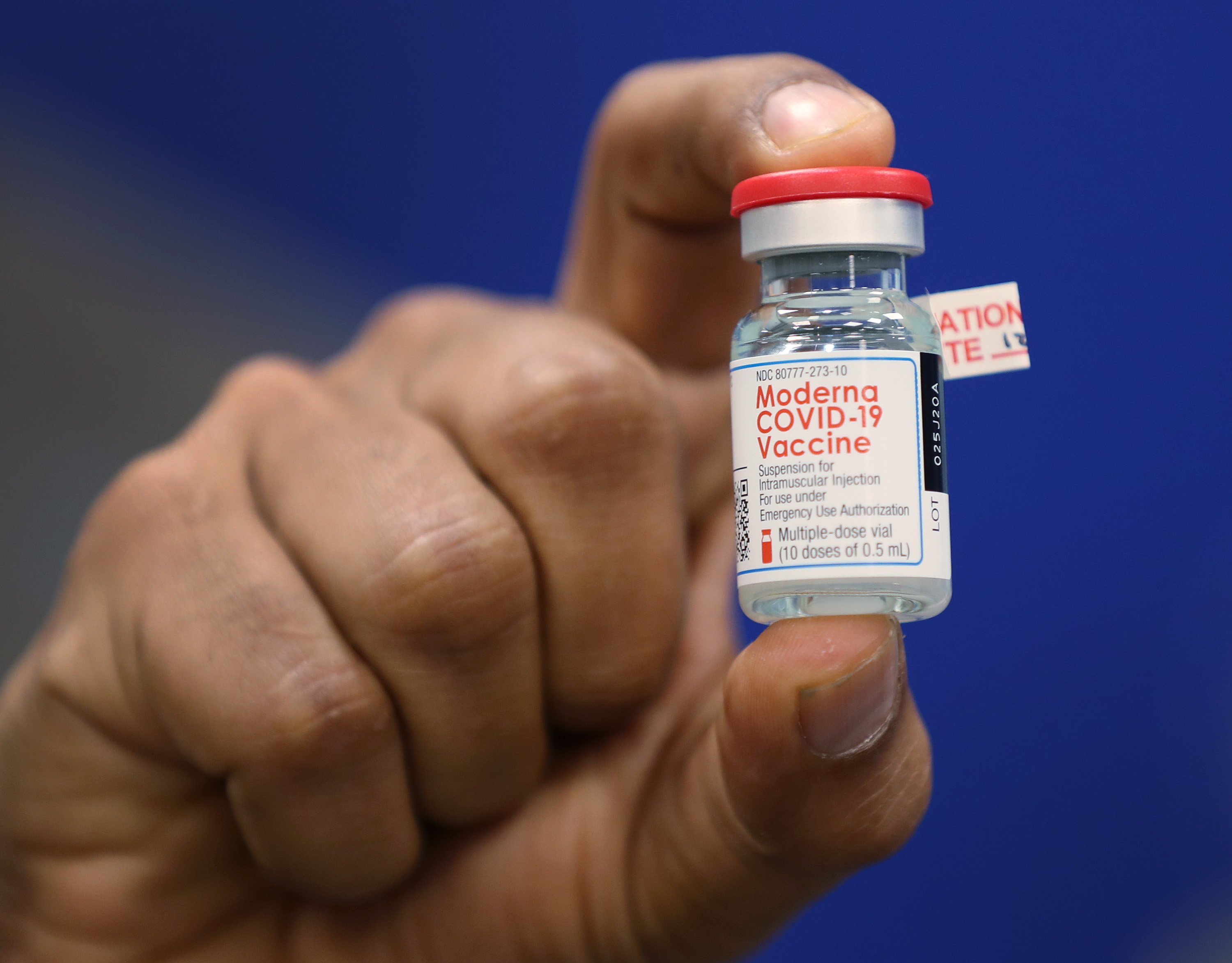
Getty ImagesDave Lacknauth, Pharm. D., Director de Servicios de Farmacia, Broward Health Medical Center muestra un frasco de la vacuna Moderna COVID-19 durante una conferencia de prensa el 23 de diciembre de 2020 en Fort Lauderdale, Florida.
Según información suministrada por la cadena Reuters, citad por El País, la farmacéutica estadounidense, lanzó un primer estudio para diseñar una nueva vacuna contra el coronavirus. Esta nueva dosis seria una vacuna que necesite menos rigurosidad en su almacenaje y conservación, requiriendo solo una temperatura ajustable a la de un refrigerador normal, contrario de la que existe actualmente que necesita un congelamiento de menos de 20º.
Asimismo, Moderna se refirió de esta vacuna como una alternativa que facilitaría el proceso de vacunación de los países mas relegados y en vía de desarrollo, donde no se cuenta, ni se facilita toda la logística que requiere la conservación de la vacuna actual.
Según Reuters, la vacuna de Pfizer exige una temperatura, en principio, aún más baja: de -70º.
“El estudio en fase inicial evaluará la seguridad e inmunogenicidad de la vacuna de nueva generación, denominada mRNA-1283, en tres niveles de dosis, y se administrará a adultos sanos en una sola dosis o en dos con un intervalo de 28 días, afirmó la empresa. Moderna también tiene previsto evaluar la nueva vacuna como de refuerzo en futuros estudios.”
Es importante destacar que la semana anterior el laboratorio comenzó a suministrar a los voluntarios de un estudio de refuerzo, la vacuna del Covid-19 dirigida a combatir la variante sudafricana, al igual los candidatos a la vacuna de refuerzo se probarán en un ensayo de una vacuna específica para la variante y otra multivalente, dirigida a cubrir de todos los linajes del virus. Añadió Reuters.
LEER MÁS: ¿Cuándo es el Día de San Patricio 2021?

