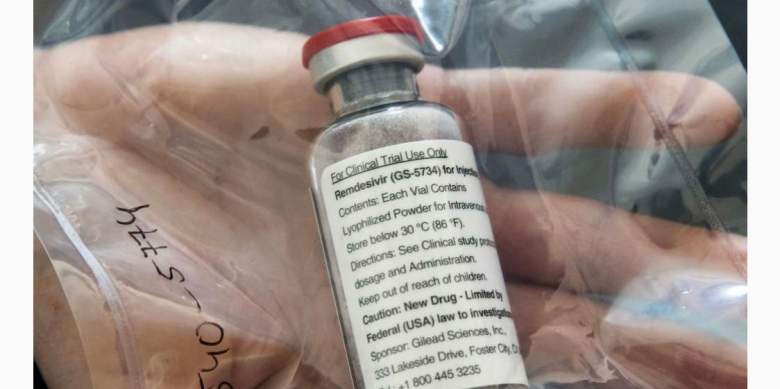
Un medicamento desarrollado originalmente para el Ébola se muestra prometedor en la lucha contra el COVID-19, según los primeros resultados de ensayos clínicos.
El medicamento en investigación, remdesivir, se está utilizando en siete ensayos clínicos en todo el mundo. Daniel O’Day, presidente y CEO de Gilead, la compañía que fabrica el medicamento publicó una carta abierta en el sitio web de la compañía donde habló sobre los nuevos hallazgos.
Aunque dijo que los resultados de los estudios clínicos aún son muy preliminares y se necesitan muchos más estudios, también dijo: “Los resultados, que cubren a 53 de los primeros pacientes que han sido tratados en el programa, muestran que la mayoría demostró una mejoría clínica después de tomar remdesivir “.
O’Day dice que todavía hay muchas incógnitas sobre el efecto del medicamento sobre COVID-19 y cuál sería la mejor manera de usarlo como tratamiento para combatir el virus.
“Al estudiar remdesivir, la pregunta no es solo si es seguro y efectivo contra COVID-19, sino en qué pacientes muestra actividad, cuánto tiempo deberían recibir tratamiento y en qué etapa de su enfermedad sería el tratamiento más beneficioso. Se necesitan muchas respuestas, por eso necesitamos múltiples tipos de estudios que involucren a muchos tipos de pacientes”.
También dice que se sabrá más en las próximas semanas a medida que lleguen más resultados de ensayos clínicos, pero señala que al mismo tiempo que están probando un medicamento en investigación, también están tratando de entender un virus que nunca se había visto antes.
“El virus surgió y se propagó a una velocidad intensa que todos están trabajando rápidamente para comprenderlo. Nuestra interpretación de los resultados también estará determinada por lo que seguimos aprendiendo sobre la enfermedad”, escribió O’Day.
Un estudio encontró que Remdesivir mejoró los síntomas en el 68% de los pacientes con COVID-19
Según un estudio publicado en The New England Journal of Medicine en abril 10, se observó mejoría clínica en 36 de 53 pacientes que recibieron remdesivir por vía intravenosa durante 10 días. Sin embargo, siete pacientes que recibieron el tratamiento fallecieron. Los pacientes en el estudio estaban en los Estados Unidos, Canadá, Europa y Japón.
El Dr. Jeffrey Galvin del Instituto de Bienestar Médico Vitality en North Carolina habló sobre los hallazgos en un video de Facebook Live.
El médico certificado en emergencias y obesidad avalado por la junta dijo que si bien estos son datos iniciales de una pequeña muestra de pacientes, sí mostraron una mejora en las tasas de mortalidad.
“El dieciocho por ciento de los pacientes con ventilación asistida murieron, lo cual es mucho mejor que el 50% al 80% que vemos habitualmente con pacientes con ventilación”, dijo.
Hay varios ensayos clínicos concurrentes de remdesivir sucediendo a nivel mundial. Stat News informa que uno de esos ensayos se realizó en la Medicina de la Universidad de Chicago.
Según Stat News, el hospital realizó ensayos en 125 personas con COVID-19; De ellos, 113 tenían una enfermedad grave. La mayoría de esos pacientes han sido dados de alta; Dos murieron.
Un participante en el estudio, Slawomir Michalak, de 57 años, dijo a Stat News que fue al hospital un viernes con fiebre de 104 y dificultad para respirar. Aceptó ser parte del estudio y el sábado le dieron su primera dosis de remdesivir. “Mi fiebre bajó casi de inmediato y comencé a sentirme mejor”, dijo Michalak.
Stat News informó que cuando recibió su segunda dosis el domingo, Michalak estaba siendo retirado del soporte de oxígeno. Después de otras dos infusiones diarias de remdesivir, para el martes estaba mucho mejor y le dieron de alta del hospital.
“Remdesivir fue un milagro”, dijo a Stat News.
Remdesivir no está aprobado por la FDA y sus efectos secundarios no son completamente conocidos
Aunque el medicamento está mostrando cierta promesa para ayudar a los pacientes con COVID-19, el medicamento no está completamente listo para despliegues masivos. En una declaración la compañía reconoce que remdesivir no ha sido aprobado por la FDA y todavía se considera un medicamento de investigación.
La carta dice: “No se ha demostrado que sea seguro o efectivo para ningún uso. Existe la posibilidad de resultados desfavorables de ensayos clínicos en curso y adicionales que involucren remdesivir y la posibilidad de que Gilead no pueda completar uno o más de dichos ensayos en los plazos actualmente previstos o en absoluto”.
La carta continúa diciendo que la compañía ni siquiera está segura de si podrán continuar desarrollando el medicamento hasta que sepan más sobre sus efectos en las personas, e incluso si resulta ser completamente seguro y aprobado por la FDA, es posible que no puedan producir tanto como sea necesario con el número elevado de casos y una necesidad tan apremiante de tratamiento.
Sin embargo, el estudio NEJM dice que “remdesivir parece tener un perfil de seguridad clínica favorable, según lo informado sobre la base de la experiencia en aproximadamente 500 personas, incluidos voluntarios sanos y pacientes tratados por infección aguda por el virus del Ébola, y respaldados por nuestros datos”.
O’Day de Gilead dice que esperan tener más datos de los estudios clínicos de remdesivir para tratar COVID-19 a fines de abril.
Versión original en inglés de Heavy.com aquí.